医工学コース
教 授 高橋 英嗣 (TAKAHASHI Eiji)
E-mail:eiji [at] cc.saga-u.ac.jp (メールアドレスは [at] を@に変更してください)
 |
|
| 専門分野: | 生理学,医用生体工学 |
| 所属学会: | International Society on Oxygen Transport to Tissue (ISOTT), American Physiological Society,日本生理学会,日本生体医工学会,酸素ダイナミクス研究会, 日本血液代替物学会 |
| その他 : | ISOTT2008 President, ISOTT Executive Committee Board, 酸素ダイナミクス研究会会長, MiP2003 Co-President,日本生理学会評議員,日本血液代替物学会評議員,日本生理学会認定生理学エデュケーター |
佐賀大学教員総覧データベース 研究室HP
生きた臓器や細胞を対象に,細胞内の様々な分子の可視化(バイオイメージング)を通じて臓器や細胞の機能を研究しています.観察対象とする分子は主に酸素分子です.
 A. 酸素不足に対する細胞の適応
A. 酸素不足に対する細胞の適応
 私たちは酸素がなければ生きてゆく事はできません.
私たちは酸素がなければ生きてゆく事はできません.私たちは食餌として取り入れたエネルギー基質を,体内でゆっくり燃やす(酸化する)ことにより,生命活動に必要なエネルギーを獲得しますが,ここに酸素が必須なのです.
この酸化反応がおこるのが細胞内小器官のひとつであるミトコンドリア(図1)です.細胞への酸素供給と酸素を利用したミトコンドリアのエネルギー生成の関連,さらには酸素供給が低下した場合,細胞はそのような危機をどう切り抜けるかについて,バイオイメージングを駆使して研究しています.
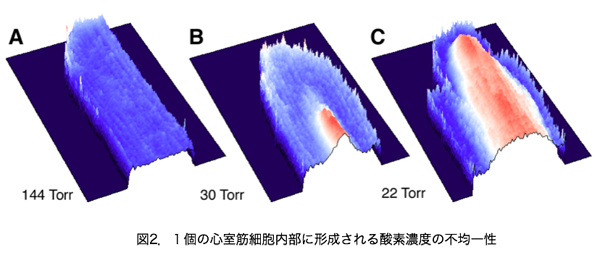
図2はラットの心筋(心室を作っている筋肉細胞で幅は10〜25µm,長さは50〜100µm程度)の内部の酸素の分布をイメージングしたものです.見やすいように長軸の中央で半分に切ったような画像処理を施しています.酸素濃度の高い所が青,低い所(ミトコンドリアが酸素不足に陥っている所)が赤で表示されています.図2のBでは,細胞の縁の部分は青く十分酸素があるにもかかわらず,細胞の中心部で酸素欠乏がおこっていることがわかります.酸素は細胞の表面から中心部に向かって拡散で移動しますが,この結果は,拡散スピードが細胞内のミトコンドリアによる酸素消費スピードに追いつかない場合があることを示唆しています.このような場合,心筋細胞は無事に生き延びることが可能なのでしょうか?
この答えはコチラをご覧ください.
 B. 酸素なしの呼吸
B. 酸素なしの呼吸
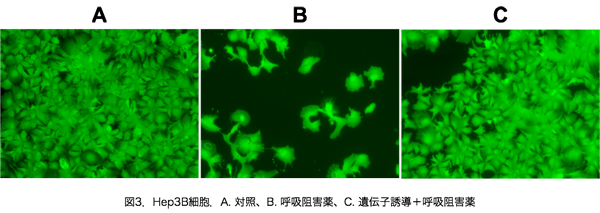
上に述べた“A. 酸素不足に対する細胞の適応”では,生命維持における酸素の重要性を力説しました.しかし,ここでは,酸素を利用せずに生命を維持するメカニズムについて研究しています.図3は,Hep3Bという肝臓ガンに由来する細胞に,ミトコンドリアの酸素利用(ミトコンドリア呼吸と呼びます)を止める薬物(antimycin A)を投与した結果です.酸素は生命維持に大切ですので,薬物を投与された細胞は死んでしまい生き残っている細胞はごくわずかです(B).この細胞に,ある種の遺伝子発現を人工的におこしてやると,細胞はほとんど死ななくなります(C).つまり,酸素がなくても生きることのできるがん細胞ができたのです.
毎年,多くの人ががんで亡くなっています.研究者の長年の努力にもかかわらず,がんをコントロールすることは今でもできておらず,正常な細胞と異なるがん細胞の特徴を理解した治療法の開発が必要です.多くの固形がんは,酸素の乏しい環境でも生きることができ,その劣悪とも言える酸素不足の環境を積極的に利用して浸潤や増殖を行うというやっかいな特徴を持っています.
上で述べたHep3B細胞の実験結果は,これまでに調べることのできた他の正常細胞やがん細胞では見ることができませんでした.Hep3B細胞で見られた酸素を必要としない生存が,がん細胞の特殊性を理解する入り口になればと思っています.
 C. がんの転移メカニズム ー がん細胞は酸素を求めてさまよう?
C. がんの転移メカニズム ー がん細胞は酸素を求めてさまよう?
がん細胞がもともと発生した部位で増殖し形成する原発腫瘍に起因する死亡は,がんによる死亡原因の10%にすぎないことが知られています.残りの90%は,原発部位から離れた部位のがん病変がもとで亡くなります.従って,このような体内におけるがん細胞の移動(転移)を阻止することは,重要な治療となります.がん細胞が原発部位から離れた臓器に転移する場合,血流にのってがん細胞が移動することがあります.私たちは,がん細胞が自ら原発がん組織内の血管に向かって移動し,最終的に血管内に侵入することが血流性遠隔転移の初期ステップではないかと考えています.その時,細胞移動(遊走)の目印になるのが酸素です.つまりより酸素が豊富な血管内に向けて,がん細胞は自ら遊走するという仮説です.
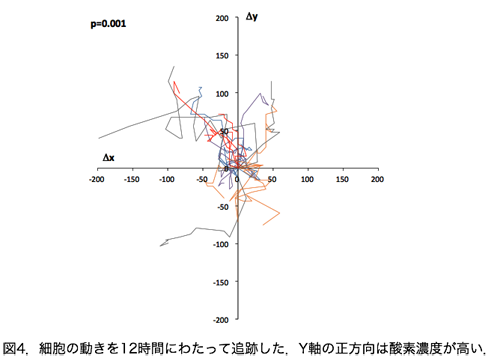
この仮説を検証するためには,細胞培養ディッシュの中に酸素濃度の低い部位と高い部位を人工的に作ってやり,その環境の中で細胞がどちらに向かって移動するかを見てやればよいのです.現在,このような酸素環境を非常に簡単な方法で作ることができるようになりました.図4はMDA-MB-231というがん細胞の動きをプロットしたものです.この細胞が酸素に関係なくランダムに遊走するとすれば,その軌跡も特定のパターンはもちません.ところが図4では,細胞がy軸の正方向(これは酸素濃度が高い方向です)へ向けて遊走する傾向があることが見て取れます(統計学的にも有意でした).
この研究の一部は,現在,日本学術振興会科学研究費補助金(26430117)により遂行しています.
 |
 |
 |
 |
